I. Définition :
a. oxydation : réaction au cours de laquelle un élément perd des électrons
Fe 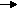 Fe2+ + 2 e- (transformation du fer métallique en ions Fe2+)
Fe2+ + 2 e- (transformation du fer métallique en ions Fe2+)
b. réduction : réaction au cours de laquelle un élément gagne des électrons
Ag+ + 1 e 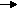 Ag (transformation des ions argent en argent métallique)
Ag (transformation des ions argent en argent métallique)
 Historiquement, les termes "réduction" et oxydation" désignaient des réactions au cours desquelles un ajout ou une perte d'oxygène était observée, comme dans le cas de l'apparition de rouille (oxyde de fer).
Historiquement, les termes "réduction" et oxydation" désignaient des réactions au cours desquelles un ajout ou une perte d'oxygène était observée, comme dans le cas de l'apparition de rouille (oxyde de fer).
II. Mise en évidence des réactions d'oxydoréduction :
1. Cu(s) + Ag+NO3-(aq)
|
Au temps t = 0 (gauche), le cuivre est de coloration brune orangée brillant.
Après quelques minutes (droite), le cuivre métallique disparaît, la solution bleuit et l'on peut constater l'apparition de paillettes brillantes. Il y a également apparition de bulles.
|
2. Zn(s) + Cu2+SO42-(aq)
|
Au temps t = 0 (gauche), la solution est de couleur bleue.
Après quelques minutes (droite), les pastilles de zinc noircissent, la solution se décolore et l'on constate l'apparition de paillettes de cuivre métallique en surface.
|
III. Mise en équation et terminologie :
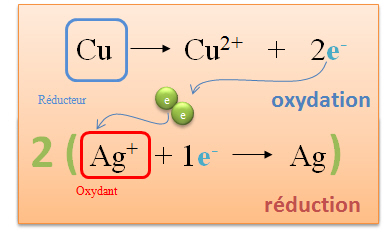
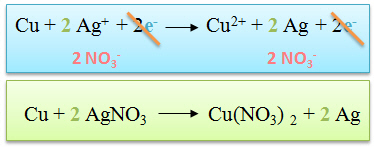
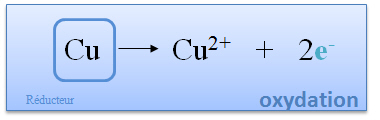 | Le cuivre perd au cours de la réaction deux électrons. Cette réaction se nomme oxydation. Le cuivre est appelé réducteur, car c'est lui qui donne des électrons. |
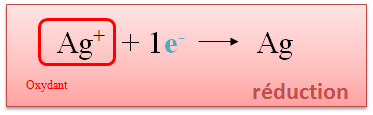 | L'argent (sous forme d'ion) capte un électron libéré par le cuivre. L'argent est appelé oxydant. Cette réaction se nomme réduction. |
| Deux électrons sont libérés par le cuivre, or l'ion argent ne peut en capter qu'un seul. Pour équilibrer cette réaction, il faut qu'un atome de cuivre réagisse avec deux ions argent. |
|
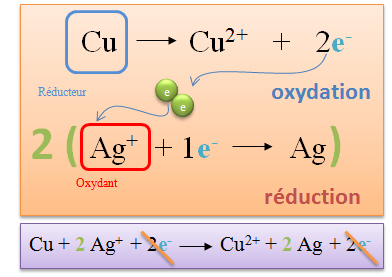 | L'on écrit ensuite l'équation bilan en additionnant membre à membre de part et d'autre de la flèche de réaction.
L'on peut simplifier ce qui se trouve dans les deux membres.
|
|
| Durant ces étapes nous avons volontairement négligé les ions NO3-. On les réintègre dans les proportions définies par la pondération dans les deux membres.
On écrit ensuite l'équation sous forme moléculaire et non plus ionique.
|
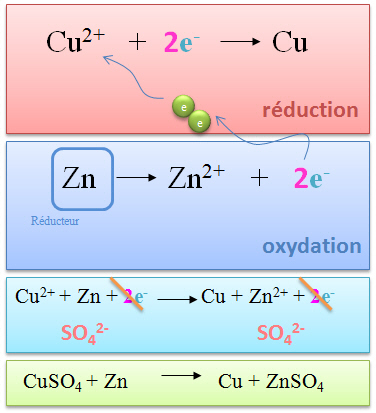 | L'on obtient l'équation ci-contre selon la même méthode.
Ici, les électrons apparaissant en même nombre, l'équation est déjà pondérée.
|
IV. Echelle d'oxydoréduction :
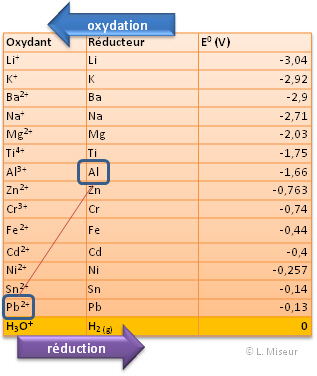
Les différents couples d'oxydant/réducteur ont été classés au sein de table. Cette classification se base sur une propriété mesurée de façon empirique. Il s'agit du potentiel standard de réduction.
Par convention, le potentiel standard de réduction du couple H+/H2(g) a été fixé à 0 volt. Les autres couples sont classés par-rapport à cette référence. Ces potentiels standards sont mesurés selon des conditions particulières de pression : 1 bar, de concentration : 1 mole.L-1 et de température : 25°C.
Notation :
Le potentiel standard se note : E0
Nous classerons les couples du potentiel de réduction le plus petit au potentiel de réduction le plus grand.
Comment déterminer dans quel sens aura lieu la réaction lorsque les éléments de deux couples sont mis en présence ?
Afin de pouvoir déterminer qui jouera le rôle de réducteur ou d'oxydant, il faut regarder dans la table des potentiels standards la position relative des deux couples.
Le couple qui possédera le potentiel de réduction le plus élevé sera réduit et le couple au potentiel le plus petit sera oxydé. Plus la différence entre les potentiels de réduction des couples sera élevée, plus la réaction sera favorisée.
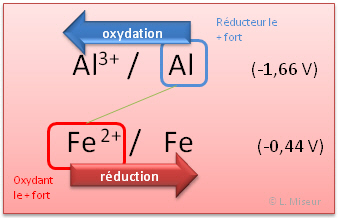
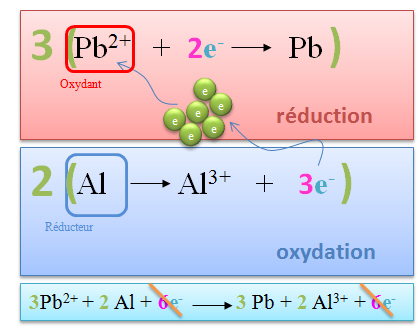
Quelle sera la réaction spontanée entre les couples Pb2+/Pb et Al3+/Al ?
Repérons les positions relatives des couples au sein de la table des potentiels.
Le couple le plus haut dans le tableau réalisera spontanément l'oxydation. Le couple situé le plus bas réalisera spontanément la réduction. Il faut donc regarder la position relative des éléments dans le tableau.
Dans notre exemple : Pb2+/Pb prend les e- (réduction) et Al3+/Al cède les e- (oxydation)
|
V. Réactivité avec l'eau :
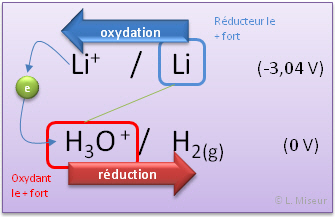
Nous avons vu que le couple H3O+/H2(g) a un potentiel de réduction de 0 volt. Or, nous savons que l'eau pure contient une faible concentration d'ions H3O+. Lors de la mise en présence de certains réducteurs, ceux-ci vont alors réagir avec l'eau pour la réduire en dihydrogène ! C'est le cas notamment des métaux alcalins.
Prenons le cas du Lithium que l'on fait réagir avec de l'eau
Le lithium, réducteur s'oxyde en ion lithium Li+ en libérant un électron. La réaction de réduction de l'eau se déroulera en même temps produisant un dégagement de dihydrogène H2(g).
Source :
http://www.lachimie.net/index.php?page=47#.VnBpgdLhDDd
Fe2+ + 2 e- (transformation du fer métallique en ions Fe2+)
b. réduction : réaction au cours de laquelle un élément gagne des électronsAg+ + 1 eAg (transformation des ions argent en argent métallique)
Historiquement, les termes "réduction" et oxydation" désignaient des réactions au cours desquelles un ajout ou une perte d'oxygène était observée, comme dans le cas de l'apparition de rouille (oxyde de fer).



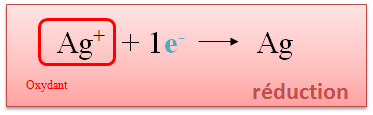


Il s'agit d'un extrait de tableau. Pour un tableau des couples redox plus complet, cliquer ici : Outils en ligne : tables kps, acides-bases, ..., puis sur l'onglet OX/RED.
Le couple le plus haut dans le tableau réalisera spontanément l'oxydation. Le couple situé le plus bas réalisera spontanément la réduction. Il faut donc regarder la position relative des éléments dans le tableau.Dans notre exemple : Pb2+/Pb prend les e- (réduction) et Al3+/Al cède les e- (oxydation)